Accueil > Science > Notions de physique 101 > Atomes et électrons
Atomes et électrons
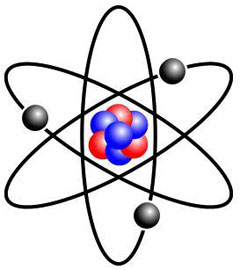
L'électricité met en jeu des forces qui sont à la base même de la structure des atomes qui constituent l'ensemble de notre monde physique. La matière et les éléments qui nous entourent sont tous formés d'atomes. Un atome est constitué en son centre d'un noyau qui se compose de neutrons et de protons. Des particules de charges négatives, les électrons, gravitent tout autour de ce noyau central. Les protons, en nombre égal à celui des électrons, ont une charge positive et les neutrons, comme leur nom l'indique, sont électriquement neutres.
Le noyau de l'atome forme l'essentiel de sa masse. Le diamètre de l'atome est 100 000 fois plus grand que son noyau. On peut donc en déduire qu'une très grande partie de l'atome est constituée de vide. Les électrons tournent autour du noyau et, toutes proportions gardées, si celui-ci avait la grosseur d'une orange, l'électron le plus éloigné serait à une distance de sept kilomètres.
Le mot atome signifie indivisible c'est-à-dire que l'on ne peut le diviser. Son origine est attribuée à Leucippe un philosophe grec né à Milet vers 460 avant Jésus-Christ. Selon ce philosophe, la matière est formée de petites particules invisibles à l'oeil nu et indivisibles. Un de ses disciples, Démocrite, reprend et élabore cette théorie avant qu'elle ne tombe dans l'oubli.
La théorie de Démocrite sera remise à l'ordre du jour, plus de 2 000 ans plus tard, par le chimiste et physicien britannique John Dalton. Son étude sur la composition des gaz, notamment de l'air, l'amène à formuler en 1801 la première théorie atomique moderne basée sur l'observation et l'expérimentation. Il formule l'hypothèse que la matière se compose effectivement de particules qu'il considère indivisibles.
Un autre britannique, le physicien Joseph John Thomson, pousse plus loin la théorie atomique en découvrant l'électron en 1897. Grâce à ses expériences, il montre aussi que l'atome se compose de charges négatives et positives.
Un élève de Thomson, le Néo-Zélandais Ernest Rutherford, qui a aussi travaillé pendant plusieurs années à l'université McGill de Montréal, montre en 1911 que l'atome contient effectivement un petit noyau très dense qui se compose de protons. Il fait également la preuve que les électrons circulent à une distance relativement grande du noyau, laissant ainsi beaucoup d'espace vide. Il compare son modèle au système solaire où les électrons, tout comme les planètes, circulent autour du noyau lequel s'apparente au soleil. En 1932, le physicien anglais James Chadwick découvre le neutron, une particule du noyau de l'atome ne possédant aucune charge électrique.